ポリ(A)結合タンパク質(ポリ(A)けつごうタンパクしつ、英: poly(A)-binding protein、略称: PABP)は、mRNAのポリアデニル化テール(ポリ(A)テール)に結合するRNA結合タンパク質である。RNAと複合体を形成した際には、RNAの3'末端の安定化、ポリ(A)テールの合成の促進、mRNAの翻訳の促進など多くの機能を果たす。核内型アイソフォームは約50ヌクレオチドに選択的に結合し、ポリ(A)ポリメラーゼのRNAに対する親和性を高めることによってその活性を促進する。PABPはNMDや核細胞質間輸送など、mRNAの代謝の段階にも関与している。PABPはテールを分解から防ぎ、mRNAの産生を調節している可能性がある。PABPが結合していない場合、RNAは迅速に分解される。
構造
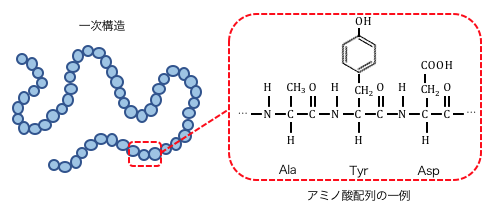
細胞質型ポリ(A)結合タンパク質(PABPC)は、4つのRNA認識モチーフ(RRM)とPABPCドメインと呼ばれるC末端領域から構成される。RRMはRNAの認識に関わる最も一般的なモチーフであり、多くの場合90–100アミノ酸からなる。NMRとX線結晶構造解析によって、RRMは2本のαヘリックスに裏打ちされた4本の逆平行βシートによって構成される球状ドメインであることが示されている。各RRMの中心部の2本のβストランドは短いリンカーで連結されて細長い凹面を形成し、ポリ(A)オリゴヌクレオチドの結合を担うと考えられている。ポリアデニル化されたRNAは伸びたコンフォメーションとなってこの凹面に沿って結合する。アデニンの認識は、2つのRRMのRNPモチーフの保存された残基との接触によって主に媒介されている。In vitroでの研究からは、ポリ(A)への結合親和性は2–7 nMのオーダーであるが、ポリ(U)、ポリ(G)、ポリ(C)に対する親和性はもっと低いか検出できないレベルである。このことは、PABPがポリ(A)に対して特異的に結合することを示している。中心部の2つのβストランドがポリ(A)の結合に利用されるため、タンパク質の他の表面でタンパク質間相互作用を行うことができる。
PABPCドメインは約75アミノ酸からなり、生物種によって4本か5本のαヘリックスから構成される。ヒトのPABPCは5本、酵母は4本であることが観察されている。このドメインはRNAと接触せず、代わりにeRF3やPAIP1、PAIP2などに存在するPABP相互作用モチーフ(PAM-2)の一部をなす15残基の配列を認識する。
ヒトの核内に存在するPABP(PABPN1)の構造は解明されていないが、1つのRRMドメインとアルギニンに富むC末端ドメインを含むことが示されている。細胞質に存在するPABPとは構造的にも機能的にも異なると考えられている。
発現と結合
哺乳類のPABPの発現はフィードバック機構に翻訳レベルでよって調節されている。PABPをコードするmRNAの5' UTRにはAに富む配列が存在し、そこにPABPが結合することでPABPの翻訳は自己調節によって抑制される。
細胞質型のPABPはC末端ドメインを介して翻訳開始因子eIF4Gに結合する。eIF4GはeIF4F複合体の構成要素であり、eIF4Fには他にmRNAの5'末端の5'キャップに結合するeIF4Eが含まれている。この結合によって、真核生物のタンパク質合成に特徴的なループ構造が形成される。この相互作用はeIF4Eのキャップ構造へのアフィニティ、PABPのポリ(A)へのアフィニティの双方を強化し、mRNAの両端をタンパク質に効果的に固定する。この結合はPABPがリボソーム40Sサブユニットのリクルートを促進する能力の部分的な支えとなっており、eIF4GとeIF3との相互作用によっても補助されている。PABPは翻訳終結因子eRF3とも相互作用することが示されている。eRF3とPABPとの相互作用は、翻訳終結したリボソームを3'末端から5'末端へリサイクルする過程を促進し、同じmRNA上での複数回の翻訳開始を促進ている可能性がある。一方、eRF3はPABPのポリ(A)上での多量体化を妨げているようであり、mRNAの分解と関係している可能性もある。
ロタウイルスNSP3
ロタウイルスのRNA結合タンパク質NSP3はeIF4GIと相互作用し、PABPをeIF4Fから除去する。NSP3はeIF4GI上でPABPに置き換わることで、宿主のタンパク質合成の遮断を担う。ロタウイルスのmRNAは3'末端にGACCモチーフが存在し、NSP3によって認識される。
ロタウイルスの感染が起こると、末端がGACCのウイルスmRNAが翻訳される一方、末端がポリ(A)の宿主mRNAの翻訳は大きく低下する。感染細胞では大幅なGACC mRNAの翻訳誘導とポリ(A) mRNAの翻訳低下がみられるが、その程度はどちらもロタウイルスの株に依存している。このことからNSP3はPABP-ポリ(A)複合体の代替として機能しており、宿主のmRNAの翻訳阻害はNSP3自身の作用ではなくウイルスmRNAとの競合の結果生じているものであることが示唆される。
NSP3によってeIF4Gから除去されたPABPC1は、ロタウイルス感染細胞の核に蓄積する。この除去過程には、ロタウイルスのNSP3、eIF4G、RoXaNが必要である。eIF4Gとの相互作用を損なうことなくNSP3-RoXaN複合体の形成を阻害するNSP3変異体の解析によって、PABP-C1の核局在にはNSP3とeIF4Gの相互作用、さらにNSP3とRoXaNのLDドメインと呼ばれるロイシンとアスパラギン酸に富む領域との相互作用が必要であることが示されている。RoXaNは、PABPC1の核-細胞質局在に関与する宿主由来のNSP3の結合パートナーとして同定された因子である。
関連する疾患
眼咽頭型筋ジストロフィー
眼咽頭型筋ジストロフィー(OPMD)は、成人で多くの場合40歳以降に発症する遺伝子疾患である。多くの場合、この疾患では顔面の筋力の低下が引き起こされ、しばしば進行性の眼瞼下垂、嚥下障害、脚や臀部など四肢近位筋の筋力低下がみられる。この疾患は歩行するために杖や歩行器が必要となる程度まで進行することが多い。OPMDは約29か国で報告されており、患者の数は集団によって大きく異なる。常染色体優性または劣性の形質として遺伝する可能性がある。
変異
PABPN1の変異がOPMDの原因となる。OPMDを引き起こす変異によって、PABPN1タンパク質のポリアラニントラクトが拡大される。余剰なアラニン配列はPABPN1の凝集を引き起こし、凝集したPABPN1は分解することができないため筋肉内で塊を形成する。こうした塊は筋細胞の正常な機能を破壊し、最終的には細胞死が引き起こされる。この筋細胞の進行性の喪失がOPMDの患者でみられる筋力低下の原因となっている可能性が高い。この疾患で大腿部や臀部など特定の筋肉のみが影響を受ける理由は明らかではない。ショウジョウバエDrosophilaでのOPMDの近年の研究からは、筋肉の変性はポリアラニントラクトの拡大のみを原因とするわけではないことが示されている。実際にはRNA結合ドメインとその結合機能が原因である可能性がある。ポリアラニントラクトの拡大が引き起こされる他の疾患と異なるのは、PABPN1が転写因子ではないという点である。PABPN1はmRNA前駆体のポリアデニル化に関与している。
研究
OPMDの研究と治療に多大な労力が払われている。筋芽細胞移植が治療法として提唱されており、フランスで臨床試験が行われている。正常な筋細胞から筋芽細胞を採取し、咽頭筋へ移植して新たな筋細胞の形成を助けるというものである。OPMDやその症状への効果を調べるため、既存の化合物や開発された化合物の試験も行われている。トレハロースは、OPMDのマウスモデルにおいて凝集体形成を低減させ、病態の進行を遅らせることが示されている。ドキシサイクリンもマウスモデルにおいて同様にOPMDの毒性を遅らせるが、凝集体形成を防ぎアポトーシスを低下させるためであると考えられている。
遺伝子
ヒトの複数の遺伝子がさまざまなPABPのアイソフォームとパラログをコードしている。ヒトのPABPにはPABPN1、PABPC1、PABPC3、PABPC4、PABPC5がある。
出典